导读
卵巢癌(OC)是全球第二大常见妇科恶性肿瘤,5年生存率低。尽管手术后基于铂的细胞毒性化疗是卵巢癌患者的标准疗法,但大多数患者会对基于铂的化疗产生耐药性,导致复发和死亡。
近年,基于DNA损伤修复的分子靶向治疗取得突破。基于合成致死的原理,聚(ADP-核糖)聚合酶抑制剂(PARPi)在由 BRCA1/2或其他DNA修复途径成员突变引起的同源重组(Homologous recombination, HR)缺陷(HR deficiency, HRD)OC中具有选择性活性。但是,仅约50%的HRD的OC患者从PARPi中获益,其余同源重组功能正常(HR-proficient, HRP)的患者疗效远弱于HRD患者。此外,接受PARPi治疗后通过多种机制(包括恢复BRCA1/2和RAD51功能的继发突变)获得HR功能也是PARPi耐药的重要原因。因此迫切需要寻求在HRP中诱导HRD的分子靶向疗法,与PARPi产生的合成致死作用,从而扩展PARPi的应用价值。
近日,四川大学华西医院生物治疗国家重点实验室赵瀛兰研究团队在Nature Communications上发表题为“Repression of LSD1 potentiates homologous recombination-proficient ovarian cancer to PARP inhibitors through down-regulation of BRCA1/2 and RAD51”的研究论文,发现在体外和多个体内模型中,赖氨酸特异性去甲基化酶1(lysine-specific demethylase 1, LSD1)的基因缺失或药物抑制可诱导HRD,从而增强HRP的OC细胞对PARPi敏感性。该研究对于今后临床上推动PARP抑制剂和LSD1抑制剂的联合使用,拓宽PARPi的应用范围具有重要意义。四川大学华西生物治疗国重陶蕾博士和周悦博士为该论文共同第一作者,赵瀛兰教授为通讯作者(zhaoyinglan@scu.edu.cn)。

通过转录组测序,作者发现LSD1抑制(分别使用小分子抑制剂,shRNA敲低或CRISPR-Cas9敲除)导致DNA损伤应答、DNA损伤修复和细胞周期检查点控制相关基因的显著抑制。基因集富集分析(GSEA)的结果进一步表明,LSD1抑制会下调参与A2780和ES2细胞的DNA双链断裂(DNA double strand breaks, DSB)修复相关基因表达。热图分析显示,在LSD1敲除组中,DNA DSB修复通路的部分基因被下调,尤其是三个 HR途径中的必需基因(BRCA1/2和RAD51)。此外,LSD1抑制还显著扰乱PARPi敏感性基因标记物表达,LSD1抑制显著提高A2780和ES2细胞的HRD分数,表明LSD1抑制损害HR途径(图1)。

图1. LSD1抑制激活DNA损伤应答(DDR)并抑制HR蛋白的表达
接着,作者通过中性彗星实验,γ-H2AX和RAD51焦点形成实验,HR和NHEJ系统报告基因等实验进一步验证了LSD1抑制损害HR功能,引起DSBs的增加(图2)。
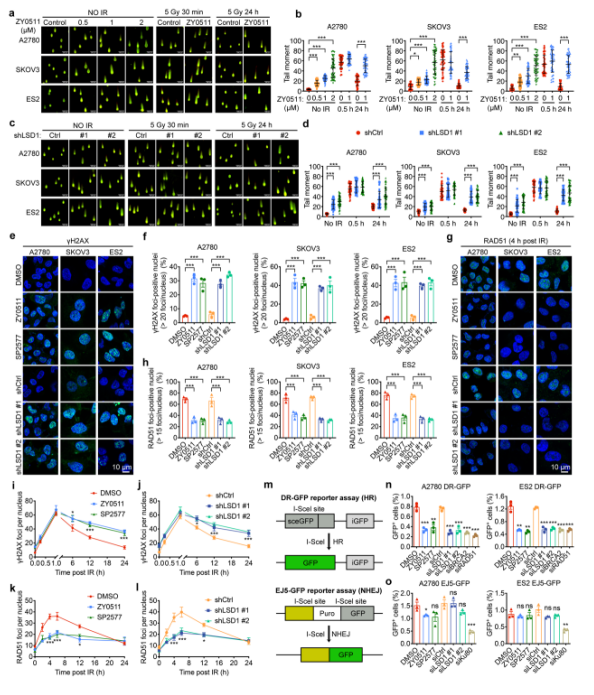
图2. LSD1抑制损害HR功能,导致DSBs的增加
在机制上,LSD1可以与BRCA1/2和RAD51的启动子区直接结合。抑制LSD1可直接损害BRCA1/2和RAD51的转录,并且这一过程依赖于LSD1经典的组蛋白去甲基化酶功能(图3)。
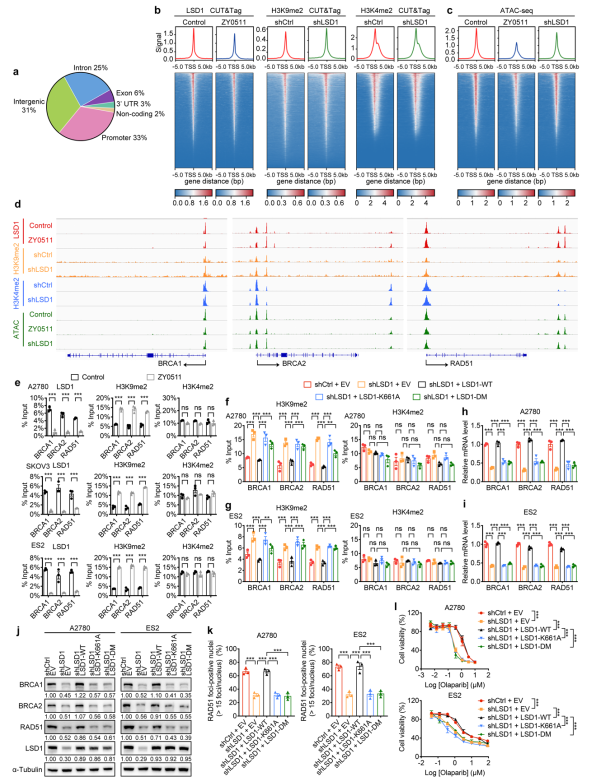
图3. LSD1依赖于其经典组蛋白去甲基化酶活性调节BRCA1/2和RAD51表达
此外,该团队开发了一种高活性、高选择性地LSD1抑制剂,命名为ZY0511,可在纳摩尔水平抑制LSD1活性。并且,在体外和多个体内模型(包括人源OC细胞皮下瘤模型,腹腔瘤模型,病人来源的PDX和PDO模型,以及在免疫功能正常的小鼠的腹腔瘤模型)中证明了抑制LSD1可诱导HRD 并增强HRP的OC细胞对PARPi的敏感性(图4)。重要的是,体内研究并未显示出基于体重、血液学和血液生化指标以及器官组织病理学参数的显著毒性,提示该联合作用的安全性。
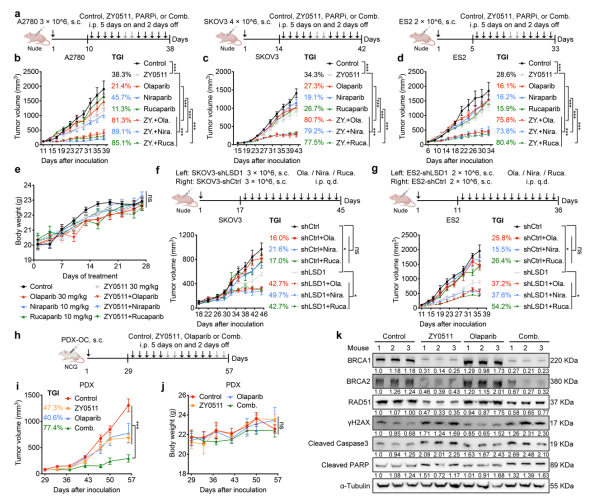
图4. 抑制LSD1增强 HRP的OC细胞对PARPi的敏感性
综上所述,该研究揭示了LSD1在调节HR中的关键作用,与LSD1抑制剂联合使用可以极大地拓展PARPi在HRP的OC患者中的应用价值,值得在人类临床试验中评估。
原文链接:https://www.nature.com/articles/s41467-023-42850-x
文章内容来源于“生物谷”公众号,本网站仅用于学术分享,如有侵权请联系管理员删除或修改。