导读
近年来,mRNA技术作为一种全新的药物形式,在疫苗生产、基因治疗和肿瘤治疗中引领变革且大放异彩。2023年诺贝尔生理学或医学奖更是授予了mRNA技术先驱Katalin Karikó和Drew Weissman。然而,如何将mRNA药物安全、高效地递送到靶组织仍然是当下面临的一个重要挑战。
“工欲善其事,必先利其器”,安全、高效的mRNA递送系统是mRNA药物成功的关键。脂质纳米颗粒(LNP)是目前临床上最先进的mRNA递送载体,LNP为mRNA递送提供了许多好处,包括制剂简单、模块化、良好的生物相容性和较大的mRNA有效载荷容量。
然而,尽管基于可电离阳离子脂质构建的LNP已经取得了巨大进展,但这些LNP的过量阳离子电荷往往导致不可避免的不良事件,包括高度炎症和细胞毒性作用。因此,如何开发颠覆性技术来克服常规LNP的阳离子性质是实现安全有效mRNA递送的主要挑战。
近日,西安电子科技大学邓宏章教授团队在《美国国家科学院院刊》(PNAS)上发表题为:Biomimetic noncationic lipid nanoparticles for mRNA delivery 的研究论文。
该研究开发了非阳离子硫脲脂质纳米颗粒(NC-TNP),通过NC-TNP的硫脲基团与mRNA的磷酸基团之间的强氢键相互作用来封装mRNA,摒弃了传统的、阴阳离子的静电相互作用,构建了非离子化的mRNA递送系统。NC-TNP制备技术简单、方便、可重复,引起的炎症和细胞毒性副作用可忽略不计,基因转染效率高,并且可以靶向脾脏递送以诱导免疫以治疗疾病。

mRNA是一种带负电荷的亲水性大分子,由于细胞膜的静电排斥作用,很难直接进入细胞,且极容易被体内的RNA酶迅速降解。因此,mRNA需要保护性外壳的包裹,例如脂质纳米颗粒(LNP),才能进入细胞。这个过程就像是包饺子,mRNA是“馅”,直接煮就散了,需要包上脂质体的“皮”才行。
经典的LNP配方由四种成分组成,分别是:可电离脂质、辅助磷脂、胆固醇和聚乙二醇化脂质,这也是目前临床上使用的mRNA递送系统。这种LNP不仅制备过程复杂,其过量的阳离子电荷也会造成高度炎症和细胞毒性等不良事件。此外,临床研究表明,LNP容易在肝脏积聚,对肝脏以外器官(如肺和肾)的递送效率较低。
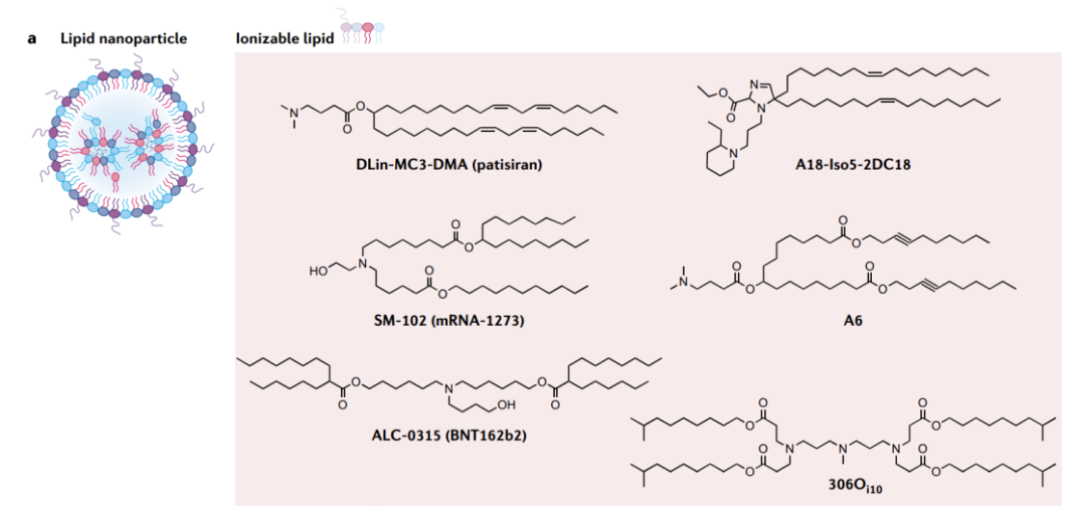
LNP由多组分自组装而成
因此,传统LNP陷入了进退两难的困境——必须要有阳离子脂质才能封装mRNA,但阳离子脂质容易引起毒副作用。
因此,摒弃通过静电相互作用包装mRNA的传统思维,开发颠覆性技术,是实现安全、高效递送mRNA的全新路径。
在这项最新研究中,邓宏章教授团队首先证明了强氢键也可以与mRNA形成稳定的配合物。基于此原理,研究团队制备了非阳离子硫脲脂质纳米颗粒(NC-TNP),通过NC-TNP的硫脲基团与mRNA的磷酸基团之间的强氢键相互作用来压缩、包装mRNA,放弃了传统的固定性和静电力。
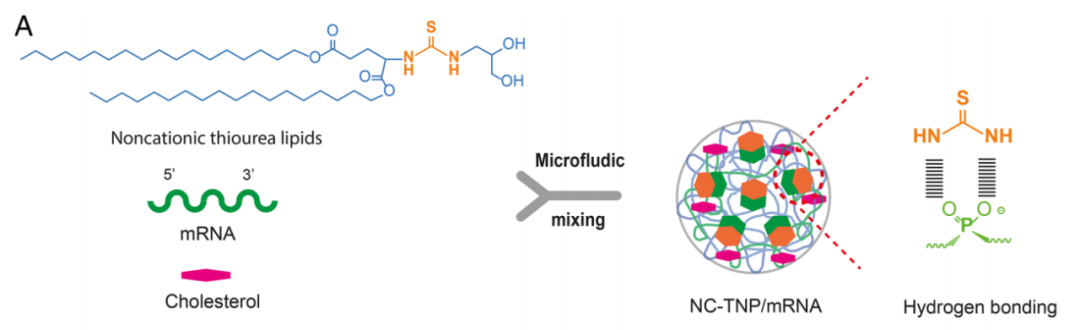
NC-TNP的设计原理图
作为一种新型mRNA递送系统,NC-TNP制备技术简单、方便、可重复,并且其引发的炎症和细胞毒性副作用很小,几乎可以忽略不计。
此外,研究团队发现NC-TNP可以逃脱外分泌途径,从而抑制内化的纳米颗粒从细胞内重新回到细胞外环境,这在传统LNP中是一个常见的现象。因此,NC-TNP封装的mRNA在体外/体内实验中的基因转染效率都高于传统LNP。
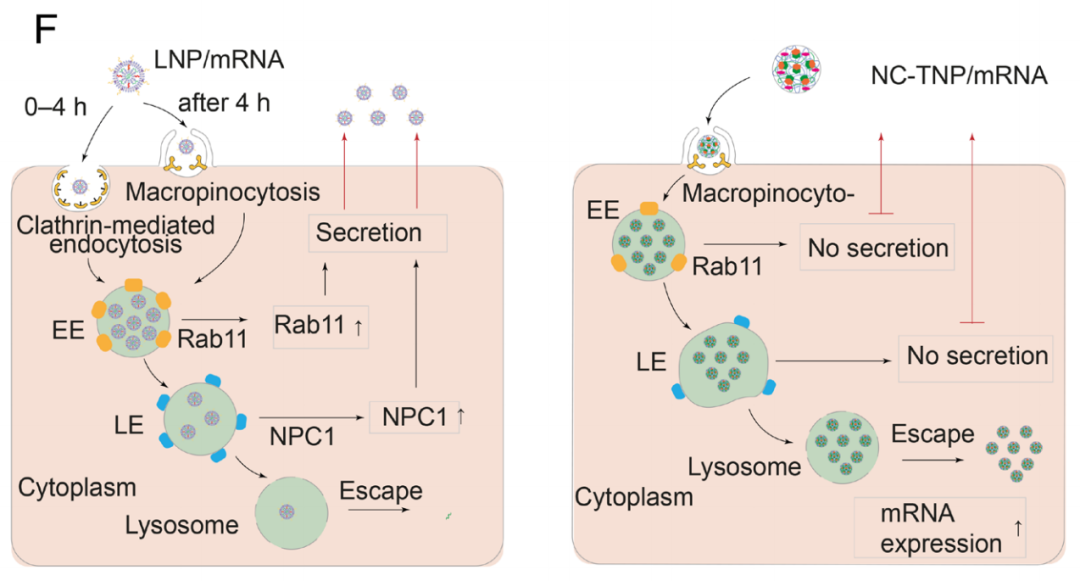
NC-TNP封装的mRNA内化和细胞内转运的机制
更重要的是,与传统LNP相比,NC-TNP表现出脾脏靶向递送能力,且积累比(脾/肝)更高。携带mRNA的脾脏靶向NC-TNP在脾脏中高表达mRNA编码的抗原蛋白,并诱导了强大的免疫应答反应。
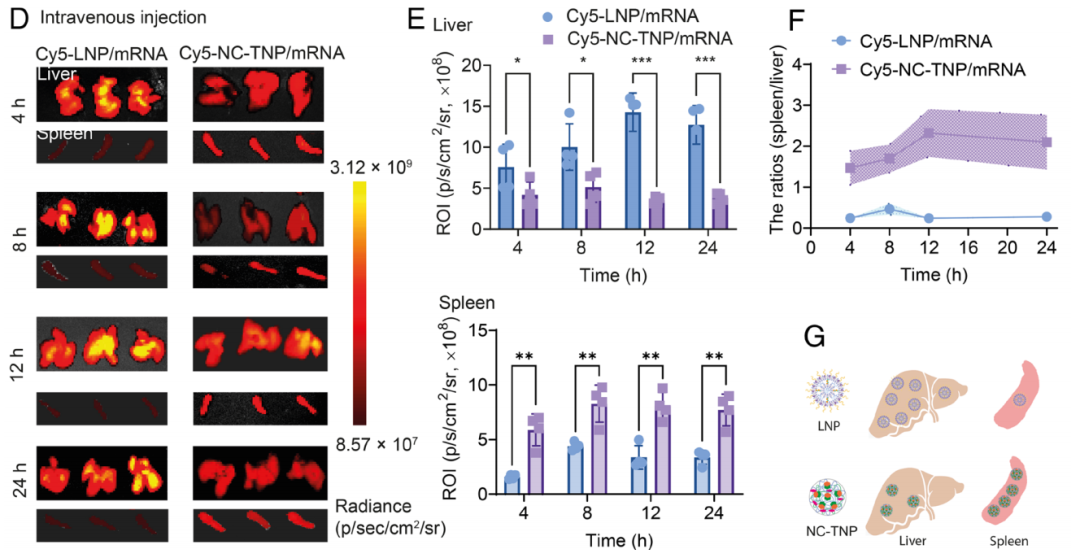
NC-TNP/mRNA靶向递送到脾脏
总的来说,这项研究构建了一种非阳离子脂质纳米颗粒——NC-TNP,通过强氢键相互作用来包装mRNA,其制备技术简单、方便、可重复,基因转染效率高,免疫副作用小,可实现脾脏靶向递送。这一发现为构建非离子化mRNA递送系统建立了概念证明,为实现安全、高效mRNA递送开辟了新的方向。
论文链接:
https://www.pnas.org/doi/suppl/10.1073/pnas.2311276120
文章内容来源于“生物世界”公众号,本网站仅用于学术分享,如有侵权请联系管理员删除或修改。