导读
RAS参与多个信号通路,翻译后修饰调控RAS的亚细胞定位从而调控下游信号转导。其中,棕榈酰化是HRAS和NRAS信号转导的必要修饰。酰基转移酶DHHC9结合辅助蛋白GCP16催化HRAS和NRAS的棕榈酰化,但GCP16与DHHC9相互作用以及GCP16调控DHHC9棕榈酰化活性的分子机制尚不清楚。
2024年1月5日,西湖大学生命科学学院胡奇团队和吴建平团队合作在Nature Structrual & Molecular Biology杂志发表了题为“Regulation of RAS palmitoyltransferases by accessory proteins and palmitoylation” 的研究论文(图1)。
该研究报道了催化RAS棕榈酰化的人源酰基转移酶DHHC9-GCP16及酵母同源蛋白Erf2-Erf4复合物的冷冻电镜结构,阐释了辅助蛋白对酰基转移酶的调控作用,发现了DHHC9中磷脂分子的结合及非活性中心的三个半胱氨酸位点(Cys24、25和288)的棕榈酰化对酶催化活性至关重要,并基于结构发现了DHHC9之外可以结合辅助蛋白GCP16并催化RAS棕榈酰化的酰基转移酶DHHC14和DHHC18。
 图1 文章截图
图1 文章截图
RAS家族活性受到GTP和GDP的调控,结合GDP时为非活性状态,结合GTP之后被激活。此外,RAS活性还受脂化修饰调控。RAS的C末端具有保守的CAAX(半胱氨酸-脂肪族氨基酸-脂肪族氨基酸-任意氨基酸)基序,半胱氨酸位点异戊烯化使RAS转运至内质网。RAS家族成员HRAS和NRAS还存在第二种脂化修饰——棕榈酰化,介导HRAS和NRAS转运至细胞膜,并激活下游信号转导。
DHHC9是已知的HRAS和NRAS的酰基转移酶。作为人体内23个半胱氨酸酰基转移酶之一,DHHC9催化长链脂酰基(通常为棕榈酰基)对RAS的CAAX序列之前的半胱氨酸侧链进行修饰。DHHC9的催化活性依赖于辅助蛋白GCP16,但GCP16与DHHC9的相互作用及DHHC9酶活性的调控机制尚不清楚。
为研究辅助蛋白GCP16对DHHC9活性的调控机制,团队表达纯化了人源DHHC9-GCP16复合物及其在酵母中的同源蛋白Erf2-Erf4复合物,并解析了二者的冷冻电镜结构(图2)。
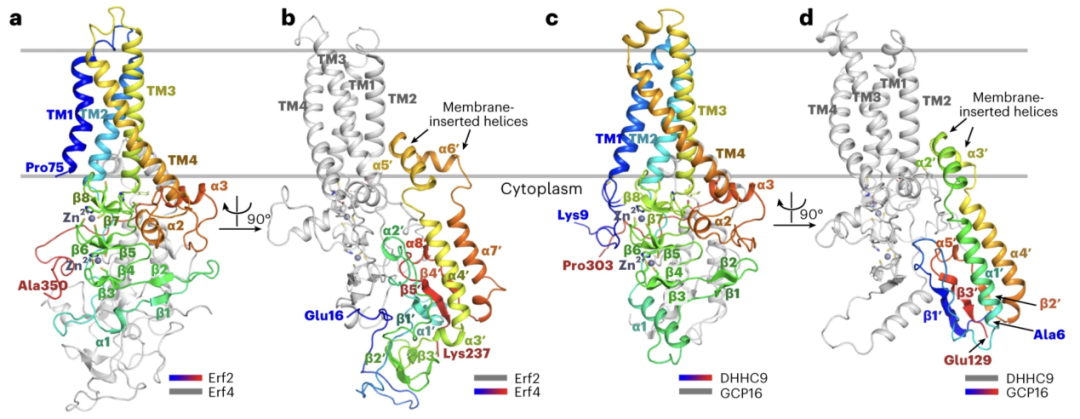
图2 RAS酰基转移酶的整体结构
结构显示,GCP16通过稳定DHHC9的结构调控DHHC9活性,而非直接参与DHHC9的催化过程(图3)。
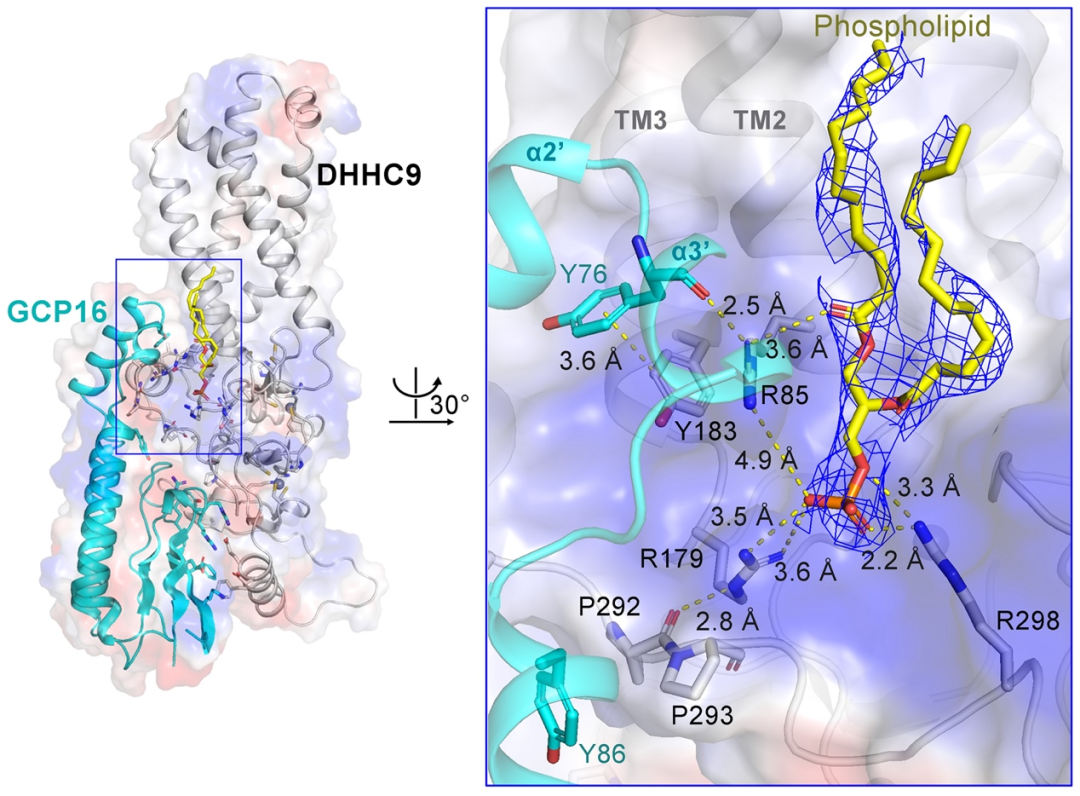
图3 DHHC9和GCP16的相互作用界面
研究团队发现,在DHHC9与GCP16相互作用界面上存在一个磷脂分子,可以稳定DHHC9构象及其与GCP16的相互作用(图3)。此外,团队在DHHC9催化中心之外的三个半胱氨酸(C24、C25和C288)上鉴定到了棕榈酰化修饰(图4)。生化实验证明这三个位点的修饰对DHHC9的催化活性十分重要,位点突变显著降低了DHHC9对底物的棕榈酰化修饰水平。
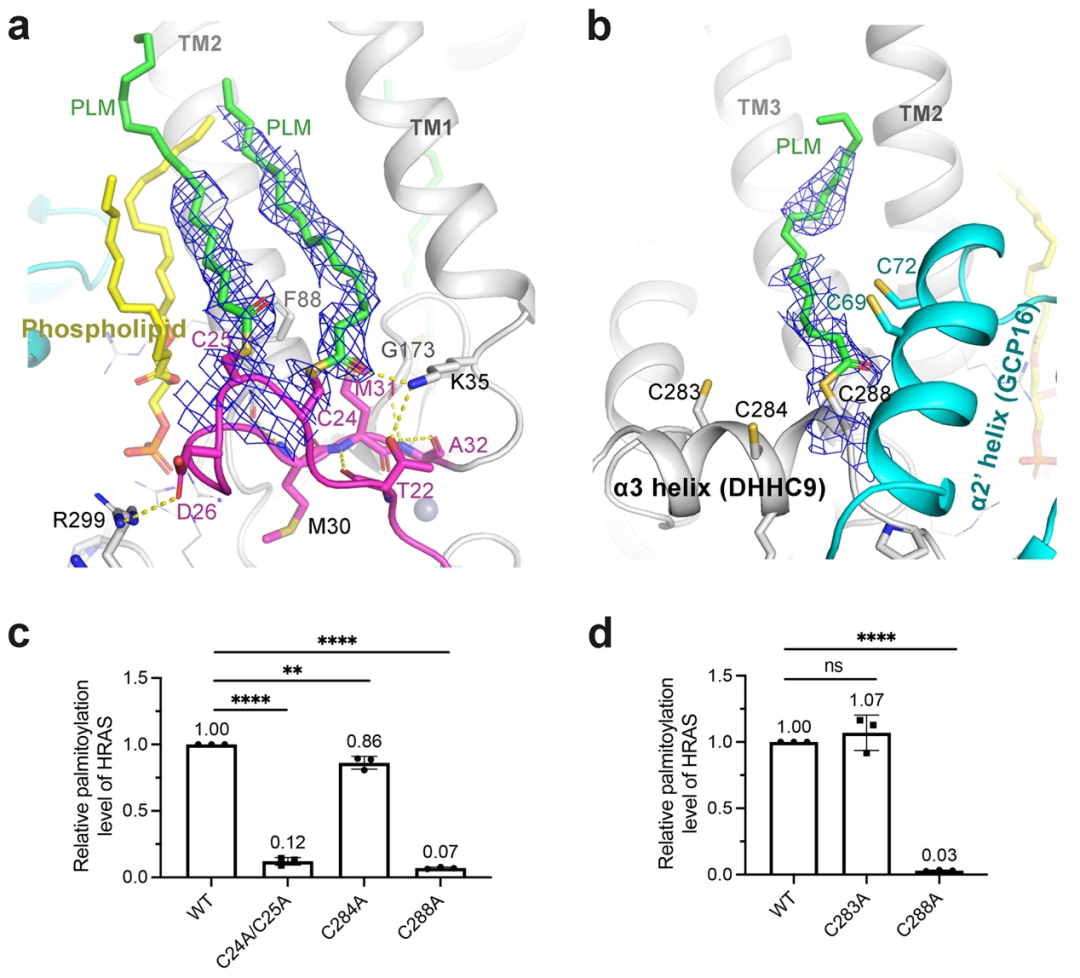
图4 DHHC9催化位点之外半胱氨酸的棕榈酰化修饰
结构分析及序列比对显示DHHC9与GCP16相互作用的氨基酸在DHHC14和18中高度保守。团队进一步验证了DHHC14和18均需要与GCP16在细胞中共表达才能拿到稳定的蛋白,并且DHHC14-GCP16和DHHC18-GCP16复合物均可催化HRAS和NRAS的棕榈酰化。在HEK293T细胞中敲降DHHC9、14或18均可降低NRAS的棕榈酰化水平并影响NRAS的亚细胞定位(图5)。
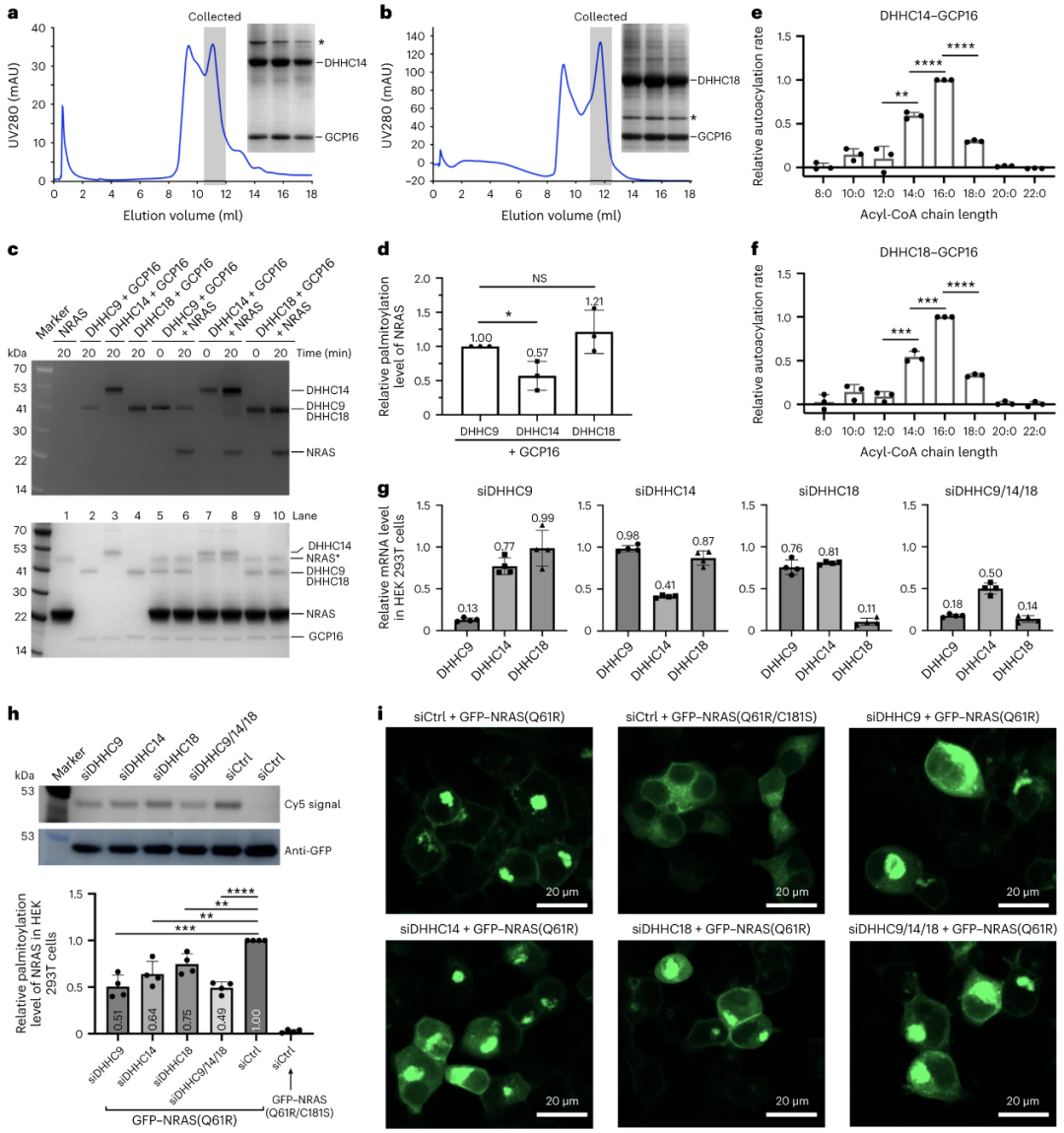
图5 DHHC14和18均可与辅助蛋白GCP16形成复合物并催化NRAS棕榈酰化
原文链接:
https://www.nature.com/articles/s41594-023-01183-5
文章内容来源于“生物谷”公众号,本网站仅用于学术分享,如有侵权请联系管理员删除或修改。