导读
T细胞白血病和淋巴瘤,统称为T细胞癌,在全世界范围内,每年新增约100000名患者。成年的复发性T细胞癌患者的5年生存率为7%-38%,他们的治疗选择有限。相比之下,B细胞癌患者有一系列靶向泛B细胞抗原的新型抗体药物和CAR-T细胞疗法,从而提高了生存率。但开发针对T细胞癌的类似治疗方法却一直具有挑战性。
正常和肿瘤性T细胞或B细胞的细胞表面表达类似的抗原,靶向泛B细胞抗原是可行的,因为治疗导致的正常B细胞再生障碍被良好耐受。然而,靶向泛T细胞抗原是不可行的,因为这会导致严重的免疫抑制。因此,T细胞癌的治疗需要更特异性地靶向癌变T细胞。
临床前研究表明,靶向T细胞受体β-链恒定区1(TRBC1)可以杀死癌变T细胞,同时保留足够的健康T细胞来维持免疫功能,这使得TRBC1成为治疗T细胞癌的有潜力的靶点。然而,首次在人类中进行的抗TRBC1 CAR-T细胞疗法临床试验报告了低反应率和CAR-T细胞的不明原因丢失。
2024年3月27日,约翰-霍普金斯大学医学院 Suman Paul 团队在 Nature 期刊发表了题为:TRBC1-targeting antibody–drug conjugates for the treatment of T cell cancers 的研究论文【1】。
该研究证实了抗TRBC1 CAR-T细胞由于被患者正常的TRBC1+ T细胞杀死而丢失,从而导致治疗反应不佳。为了解决这个问题,研究团队开发了一种靶向TRBC1的ADC药物,可以在体外杀死TRBC1+癌细胞,并在小鼠模型中治愈了人类T细胞癌。靶向TRBC1的ADC药物可能为TRBC1靶向提供最佳形式,并在T细胞癌患者中产生优异应答。

抗体药物和CAR-T细胞介导的免疫疗法已经改善了实体瘤和血液系统恶性肿瘤患者的生存率。患有T细胞白血病和T细胞淋巴瘤(统称为T细胞癌)的患者,生存期短,缺乏此类免疫疗法。因此,T细胞癌症特别需要开发CAR-T细胞疗法和抗体药物来改善患者的预后。
大多数T细胞,无论是正常T细胞还是肿瘤性T细胞,在其细胞表面都表达αβ T细胞受体(TCR)。在T细胞肿瘤中,超过90%的外周T细胞淋巴瘤(PTCL)和皮肤T细胞淋巴瘤(CTCL)都表达αβ TCR。此外,30%-50%的T细胞急性淋巴母细胞白血病(TALL)表达αβ TCR。
每个T细胞表达一个独特的αβ TCR。由于T细胞白血病和T细胞淋巴瘤源于一个特定T细胞的克隆性生长,每个肿瘤性T细胞都表达相同的独特TCR序列。因此,靶向肿瘤性T细胞中的独特TCR序列进行靶向治疗应该能够保留足够的正常T细胞,以实现细胞免疫。一种创新的方法是靶向TRBC等位基因,T细胞选择两个可能的TRBC等位基因之一:TRBC1或TRBC2。正常T细胞由大约相同数量的表达TRBC1的T细胞和表达TRBC2的T细胞组成,而T细胞肿瘤则要么表达TRBC1,要么表达TRBC2。
这一发现导致了一项1/2期临床试验,以测试抗TRBC1 CAR-T细胞疗法的安全性和有效性【2】。然而,在10名接受治疗的患者中,只有2名(20%)在12个月或更长时间内保持完全缓解,并且在这10名患者的外周血中未检测到CAR-T细胞扩增。而这种扩增对于CAR-T细胞的癌症治疗效果至关重要。
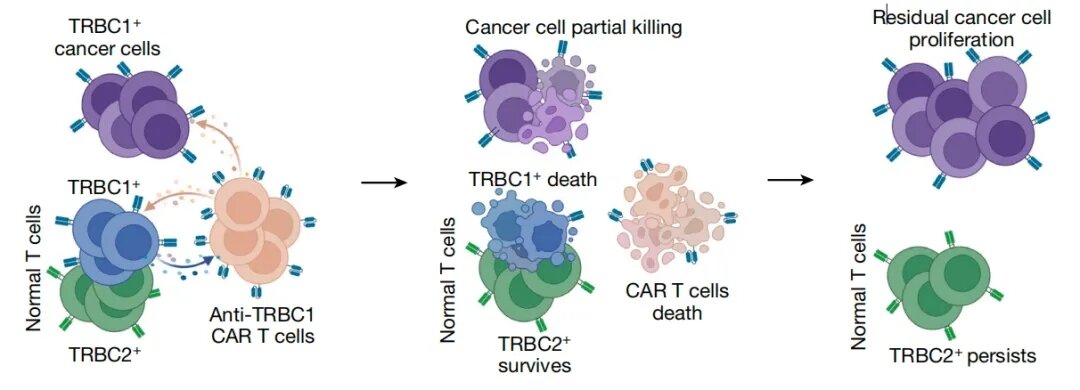
在这项研究中,研究团队证明了抗TRBC1 CAR-T细胞会被正常的TRBC1+ T细胞杀死,这可能解释了在之前的临床试验中未观察到的CAR-T细胞的有效扩增。
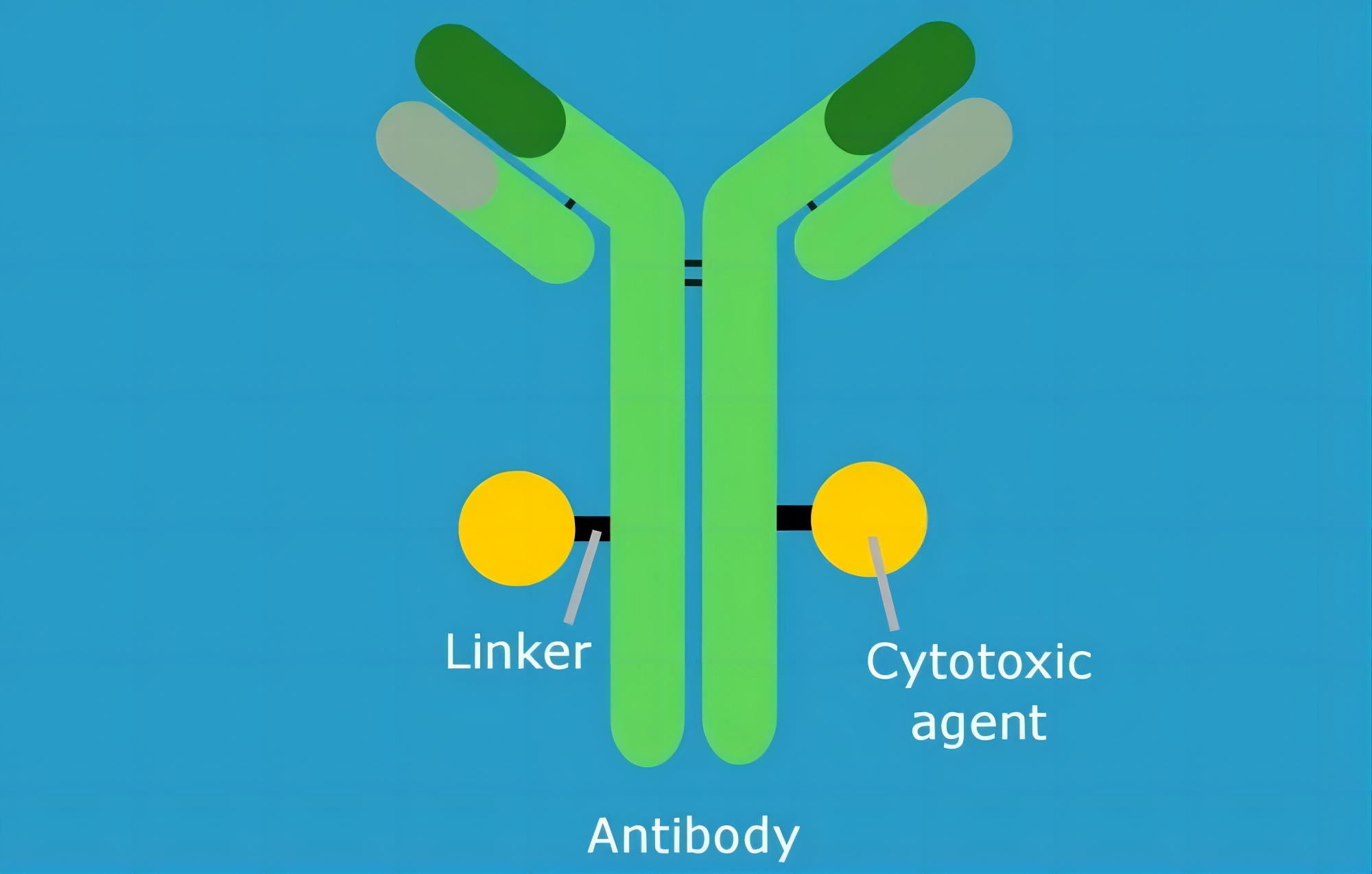
这一发现促使研究团队开发了一种治疗T细胞癌的新型抗体药物偶联物(ADC),其靶点同样是TRBC1,但其疗效不依赖于CAR-T细胞。研究团队首先确定了与抗TRBC1抗体结合的细胞毒性药物,其中表现最好的是SG3199,其作为一种ADC有效载荷,已在临床试验中得到了验证。
抗体药物偶联物(antibody-drug conjugate,ADC)是一类由抗体(antibody)、细胞毒性药物(Cytotoxic Agent)以及将两者连接起来的连接子(Linker)组成的新型靶向药物,其利用抗体的靶向性将细胞毒性分子选择性递送到肿瘤细胞,在发挥抗癌作用的同时,避免对健康细胞的伤害。
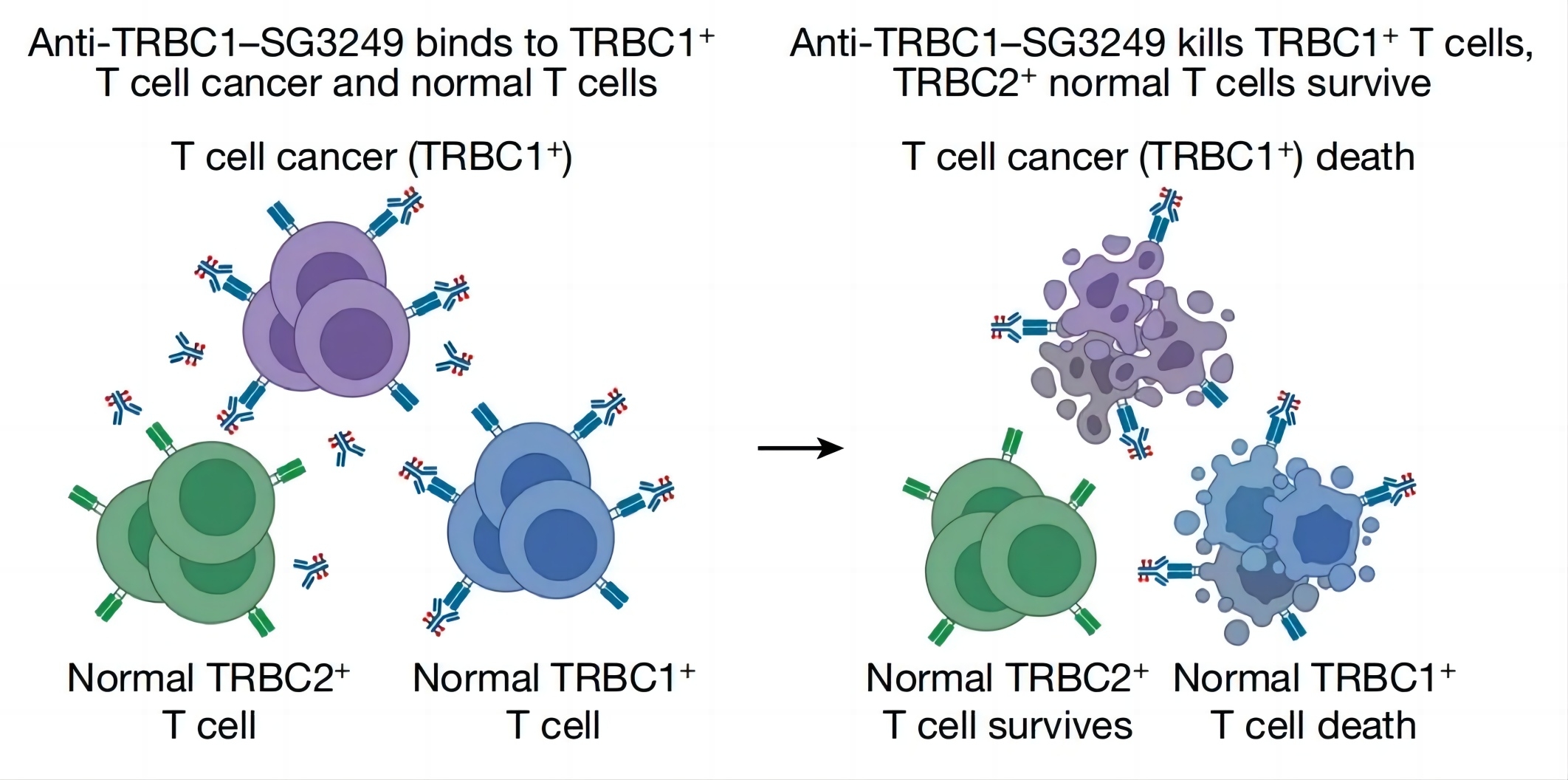
接下来,研究团队证实了正常T细胞不会影响抗TRBC1-ADC药物(抗TRBC1-SG3249)对三种TRBC1+癌细胞株的杀伤作用。此外,该ADC药物对四种TRBC1-癌细胞株没有观察到细胞毒性。研究团队还观察到该ADC药物对正常T细胞的TRBC1+亚群的剂量依赖性,而对TRBC2+亚群的毒性很小。总的来说,该ADC药物能够特异性杀伤TRBC1+细胞,而保留TRBC2+T细胞。
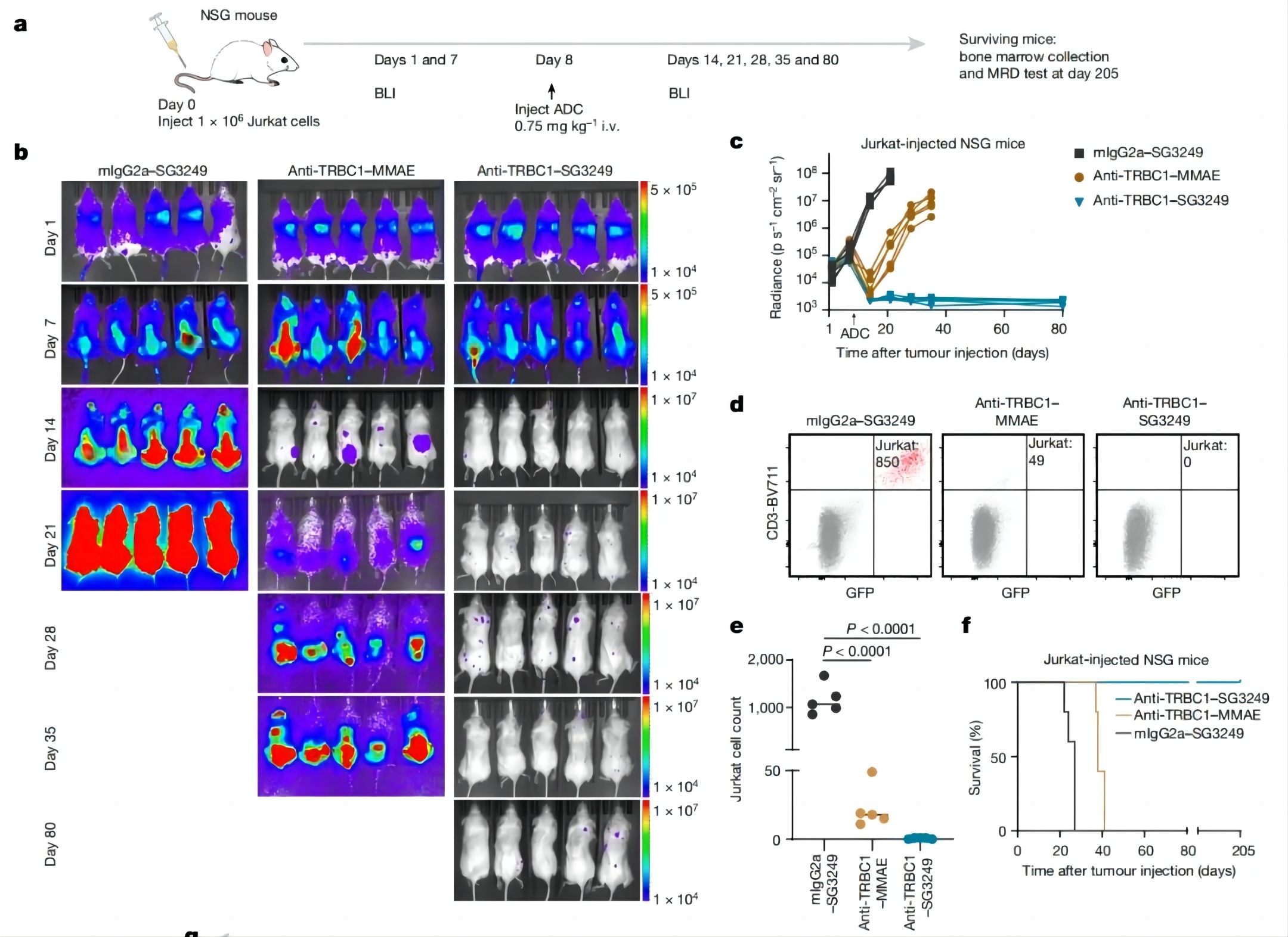
为了评估该ADC药物在体内的治疗效果,研究团队使用人类Jurkat TRBC1+癌细胞构建了肿瘤异种移植小鼠模型,然后使用该ADC药物(抗TRBC1-SG3249)进行治疗。结果显示,接受抗TRBC1-SG3249治疗后,小鼠体内的癌症几乎无法检测到,且没有观察到复发,通过流式细胞检测进一步证实了癌症的消退,小鼠的骨髓中也没有可检测到的癌细胞,也就是说,抗TRBC1-SG3249似乎治愈了这些小鼠的癌症,且没有观察到体重减轻或其他肝脏和皮肤毒性迹象。
总的来说,该研究观察到了正常的TRBC1+ T细胞与抗TRBC1 CAR-T细胞之间的双向杀伤作用,这一发现的意义超越了T细胞白血病和T细胞淋巴瘤的治疗。正常的T细胞和其他免疫效应细胞在其细胞表面含有许多蛋白,任何与这些蛋白反应的CAR-T细胞都可预期会显著降低CAR-T细胞的治疗效果。这一发现提示我们,不能期望用CAR-T细胞靶向TRBC1作为T细胞癌的最佳治疗剂。而该研究进一步证实,将抗TRBC1抗体与细胞毒性药物SG3249结合的ADC药物可作为一种有效的T细胞癌治疗剂,其在小鼠模型中的强大的治疗效果为在人类中进行临床试验奠定了有希望的概念和实践基础。
论文链接:
1. https://www.nature.com/articles/s41586-024-07233-2
2. https://doi.org/10.1182/blood-2022-165971
文章内容来源于“生物世界”公众号,本网站仅用于学术分享,如有侵权请联系管理员删除或修改。