导读
PD-1和PD-L1抑制剂促进了非小细胞肺癌(NSCLC)的治疗。这种免疫检查点阻断(ICB)治疗因持久性应答在临床上有着良好的应用前景。但目前从ICB获益的患者比例相对有限,临床迫切需要基于生物标志物的方法来识别未受益于ICB的患者。STK11/LKB1、KEAP1和EGFR突变等生物标志物,与NSCLC的ICB治疗结果相关,并有可能指导其免疫治疗。但是,这些单个生物标志物无法一致性地识别ICB耐药患者,这阻碍了其临床应用。因此我们迫切需要更具体的组合生物标志物方法。肿瘤突变负荷(TMB)被认为是NSCLC免疫治疗相关的一个强大基因组生物标志物。但是,在TMB较低的情况下,也经常观察到NSCLC的ICB治疗应答,表明单独使用TMB作为生物标志物无法高特异性地识别无应答患者。
荷兰癌症研究所的研究团队及合作者在Clinical Cancer Research发表了题为“Combining Genomic Biomarkers to Guide Immunotherapy in Non–Small Cell Lung Cancer”的文章。为了开发对NSCLC ICB治疗无应答患者具有更高特异性的组合生物标志物,研究人员对254名接受PD-L1抑制剂单药治疗的NSCLC患者进行了全面分析。发现队列包括75名接受全基因组测序(WGS)的患者,独立验证队列包括169名接受肿瘤-正常大panel测序的患者,并在低(<10个突变/Mb)或高(≥10个突变/Mb)TMB条件下评估了STK11/KEAP1/EGFR突变对ICB治疗无应答患者的特异性。研究表明,在低TMB的情况下,STK11/KEAP1/EGFR突变是ICB耐药的高度特异性生物标志物。TMB提供了一种高度特异性的组合生物标志物策略来限制NSCLC的过度治疗。

文章发表在Clinical Cancer Research
主要研究内容
研究人员利用肿瘤和匹配胚系的WGS数据精确地量化了TMB。与之前的研究结果一致,TMB作为一个连续参数,与持久的临床益处密切相关(图1A)。与高TMB患者(66%)相比,低TMB患者持久临床益处明显较低(20%)(图1B);低TMB患者无进展生存期(PFS)和总生存期(OS)显著缩短(图1C-D)。在发现队列中,虽然TMB与治疗结局密切相关,但其作为独立生物标志物的临床价值仍然有限,因此需要额外的生物标志物加以补充,以增强特异性。
此外,基于低、中或高PD-L1肿瘤细胞阳性率的患者分层只在高TMB的人群中显示显著不同的持久临床益处,而在低TMB的人群中则并非如此(图1E)。因此,综合考虑PD-L1免疫组化和TMB仍然不足以克服特异性低的问题。经分析发现,STK11突变状态和TMB是互补的生物标志物,KEAP1突变状态和TMB的联合评估也是有效的组合生物标志物策略。
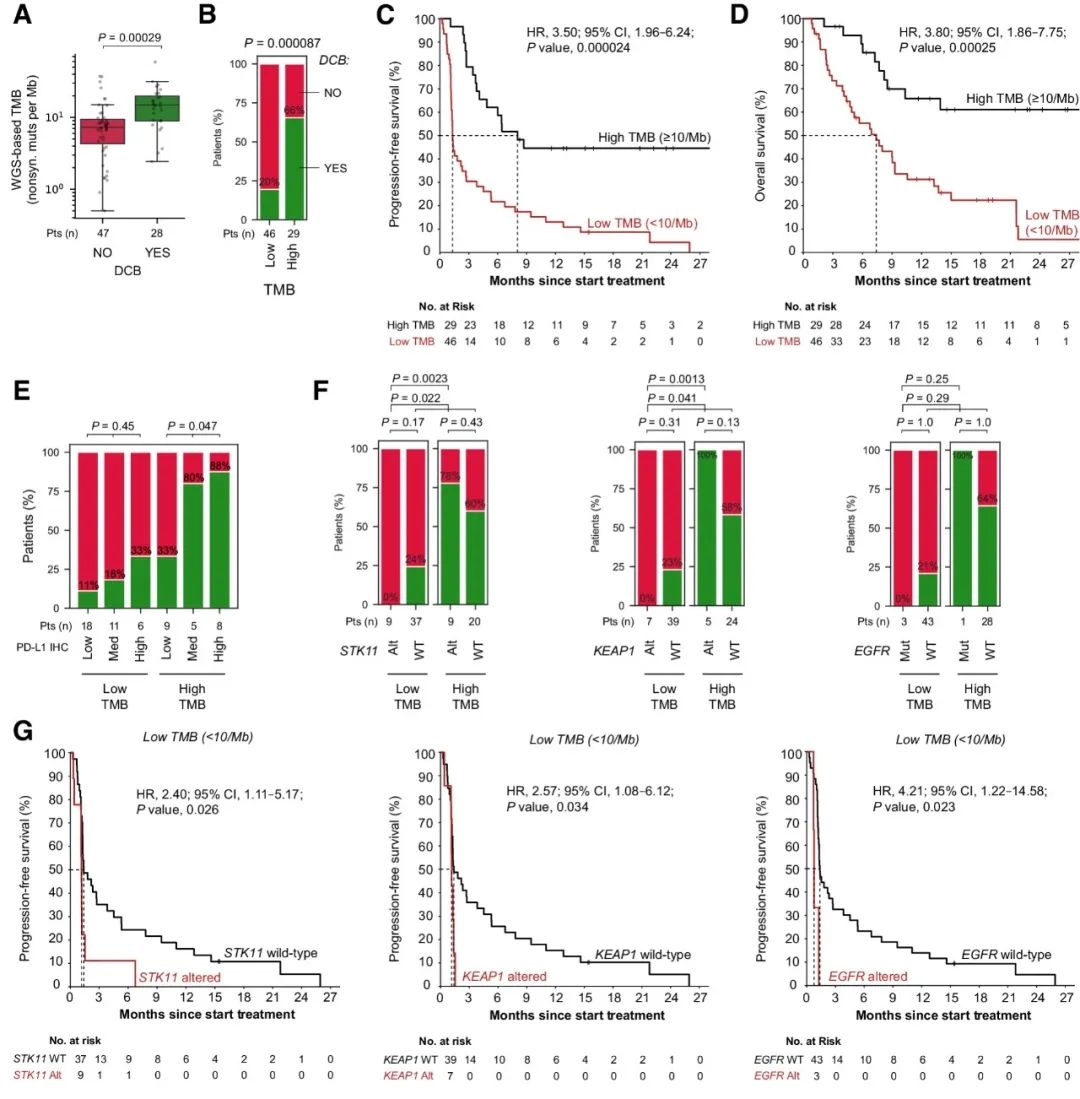
图1. 发现队列中与ICB单药治疗结果相关的生物标志物。
接下来,研究人员依据以上发现设计了组合生物标志物策略:在低TMB的条件下,预测患者在STK11、KEAP1或EGFR中发生克隆性致病突变不会获得持久临床益处。发现队列中符合以上标准的15名患者中,持久临床益处率为0%,与所有其他患者相比均显著较低(图2A)。在发现队列的TMB低亚组和高亚组中,STK11/KEAP1/EGFR突变既与TMB无关(图2B),也与大多数临床基线特征无关。仅在TMB较低的情况下,STK11、KEAP1或EGFR中克隆性致病突变与较短的PFS(图2C、D)和OS(图2E、F)密切相关。总之,TMB背景下考虑STK11/KEAP1/EGFR突变,为识别发现队列中的无应答患者提供了一种高度特异性的策略,而且不会对任何应答患者进行错误分类。
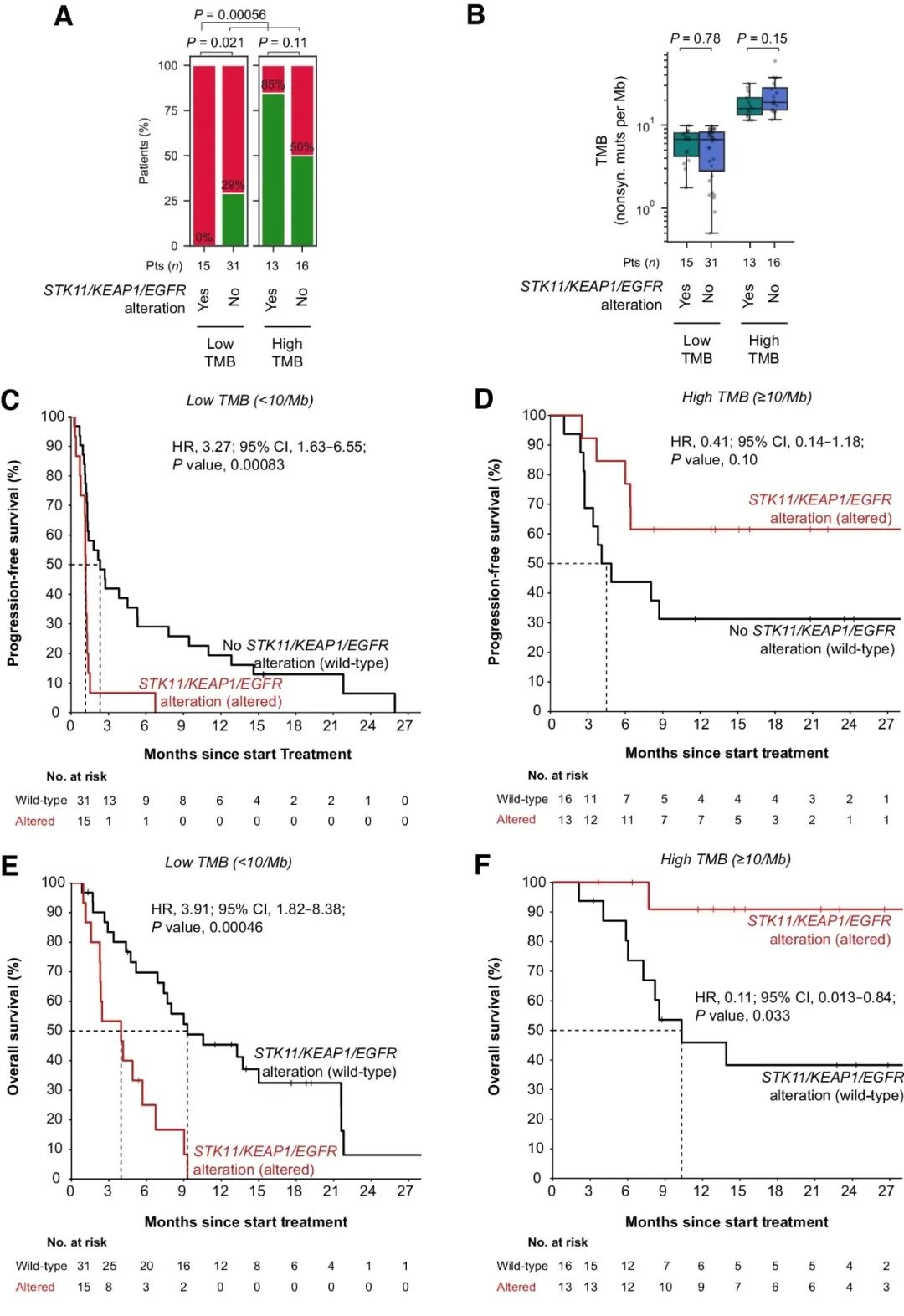
图2. 发现队列中低/高TMB条件下STK11/KEAP1/EGFR突变与ICB治疗结果的相关性。
在独立验证队列中,研究人员分析了169名接受PD-L1单药治疗的NSCLC患者数据。验证队列中的患者治疗反应率、PD-L1表达、吸烟史和预治疗史与发现队列相似,并且TMB分布在队列之间具有高度可比性(图3A)。TMB在验证队列中与持久临床益处显著相关(图3B、C)。与发现队列一致,验证队列中低TMB的患者若携带STK11、KEAP1或EGFR突变,则其持久临床益处率非常低(图3D),STK11/KEAP1/EGFR突变患者的长期PFS几乎仅发生在高TMB的情况下(图3E)。
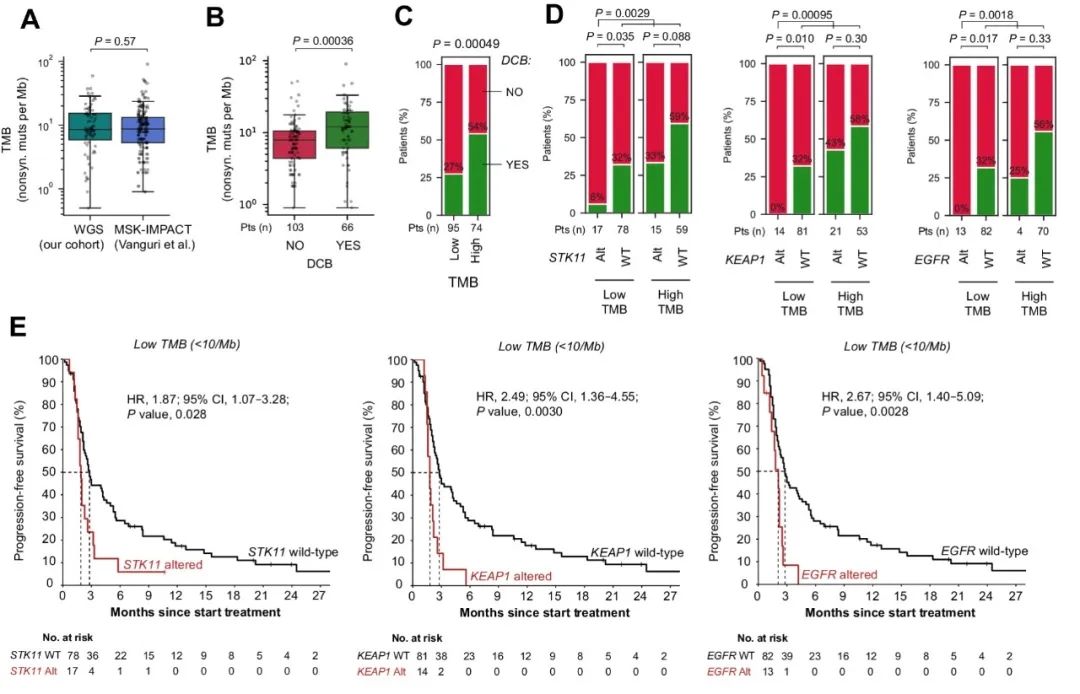
图3. 验证队列中TMB和STK11/KEAP1/EGFR突变及其与ICB治疗结果的相关性。
在验证队列中,至少携带一个STK11/KEAP1/EGFR突变的34名低TMB患者持久临床益处率为3%(1名患者),与验证队列中的所有其他患者相比显著较低(图4A)。在TMB低亚组和高亚组中,STK11/KEAP1/EGFR突变与TMB无关(图4B)。在低TMB患者中,STK11/KEAP1/EGFR突变也与较短的PFS密切相关(图4C)。相反,在高TMB人群中,携带STK11/KEAP1/EGFR突变的患者PFS更长(图4D)。STK11/KEAP1/EGFR突变与低TMB(图4E)和高TMB(图4F)人群的不良结局均显著相关。可见,将STK11/KEAP1/EGFR突变与TMB组合,为识别ICB应答极低的患者提供了一种高度特异性的策略。
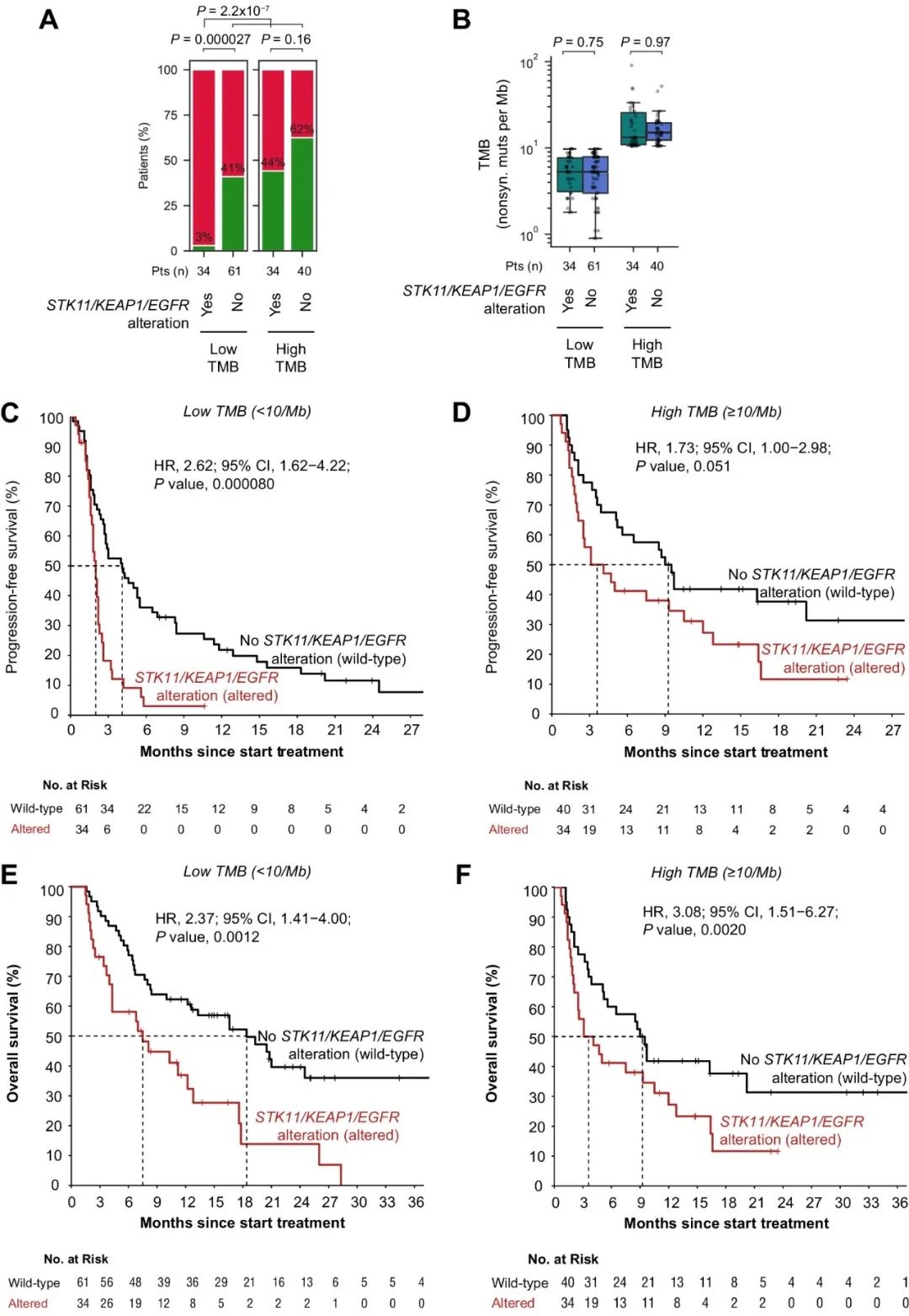
图4. 验证队列中低/高TMB条件下STK11/KEAP1/EGFR突变与ICB治疗结果的相关性。
结 语
总的来说,在低TMB患者中,STK11/KEAP1/EGFR突变是ICB耐药性的高度特异性生物标志物。在发现队列中,0/15(0.0%)的生物标志物阳性患者显示出治疗益处。在验证队列中,1/34(2.9%)的生物标志物阳性患者显示出治疗益处。高TMB患者与此不同,对于至少携带一种STK11/KEAP1/EGFR突变的患者,在发现和验证队列中分别有11/13(85%)和15/34(44%)的患者显示出持久的治疗益处。
在携带STK11、KEAP1和EGFR耐药性突变的患者中,预期之外的ICB应答几乎只在高TMB的患者中观察到。将这些基因突变纳入分析后,TMB可以为限制NSCLC的过度治疗提供一种高度特异性的综合性生物标志物策略,具有完善非小细胞肺癌患者治疗选择的临床潜力。
该研究展示了如何将已建立的NSCLC ICB治疗生物标志物有效地结合到一种生物标志物策略中,以提高识别耐药患者的特异性。STK11/KEAP1/EGFR突变患者的超低ICB应答率加上低TMB表明,对该人群不进行ICB单一治疗可能是安全的,但仍需要进行前瞻性随机随访研究来证实。
论文原文:
Combining Genomic Biomarkers to Guide Immunotherapy in Non–Small Cell Lung Cancer . Clin Cancer Res (2024). https://doi.org/10.1158/1078-0432.CCR-23-4027
文章内容来源于“测序中国”公众号,本网站仅用于学术分享,如有侵权请联系管理员删除或修改。