导读
利用双特异性T细胞接合器(BiTE)的T细胞疗法已经成为临床上多种血液类肿瘤的有效治疗方法,目前正在评估其在实体瘤治疗中的价值。BiTE是通过识别细胞表面标志物与T细胞和肿瘤细胞相互作用,诱导肿瘤细胞溶解的双特异性抗体。例如FDA批准的首个BiTE疗法——blinatumomab,它将CD3+ T细胞与CD19+ B细胞连接起来,诱导T细胞激活,极大地改善了急性淋巴细胞白血病患者的预后。目前,还有其他几种针对胶质瘤、肺癌、B细胞淋巴瘤、前列腺癌、胰腺癌和乳腺癌的BiTE疗法正在临床试验中进行研究。
然而,BiTE疗法可能导致严重的不良反应,除了目标抗原在肿瘤组织何健康组织中都有表达导致的肿瘤非靶向毒性(on-target off-tumour toxicity)之外,BiTE治疗相关的细胞因子释放综合征(CRS)和神经毒性(neurotoxicity)也经常在临床中发生,这些毒性作用限制了BiTE的更广泛应用。因此,在临床上迫切需要新的策略来帮助减轻与BiTE相关的毒性作用。
2024年2月20日,宾夕法尼亚大学 Michael Mitchell 团队(宫宁强博士为第一作者),在 Nature Biomedical Engineering 期刊发表了题为:Small-molecule-mediated control of the anti-tumour activity and off-tumour toxicity of a supramolecular bispecific T cell engager 的研究论文。
该研究开发了一种可切换的双特异性T细胞纳米接合器(SiTE),基于该方法开发的CD3×HER2双特异性抗体诱导了强烈的肿瘤特异性适应性免疫反应,防止了肿瘤复发。更重要的是,使用已获FDA批准的小分子药物金刚烷胺(AMD)分解超分子聚集体,使T细胞与肿瘤细胞分开,停止CD3×HER2产生的肿瘤非靶向毒性、细胞因子释放综合征和神经毒性。


Michael Mitchell教授和第一作者宫宁强博士(图片源自Mitchell实验室主页https://mitchell-lab.seas.upenn.edu/lab-members/)
研究表明,超分子化学可以将蛋白质组装成一维、二维或三维结构,并通过小分子控制其分解。受此启发,研究团队提出了一种可切换的双特异性T细胞纳米接合器(SiTE)用于可控的癌症免疫治疗。
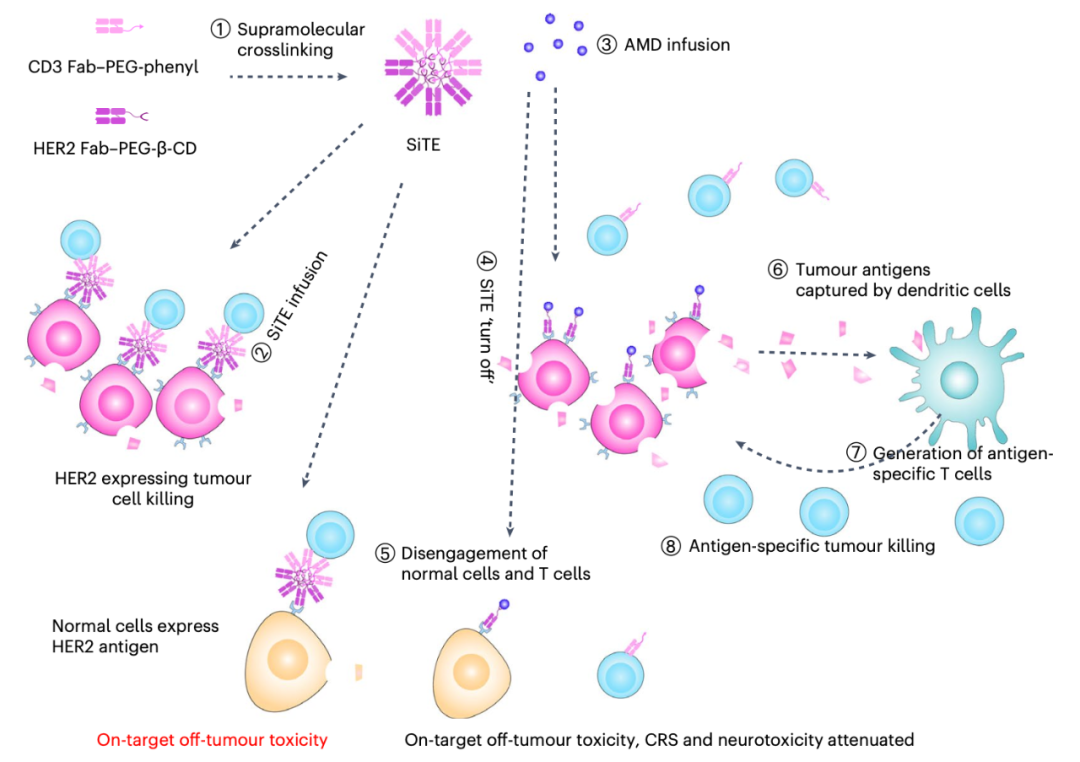
用于癌症免疫治疗的SiTE
与传统双特异性T细胞接合器(BiTE)类似,SiTE可以结合T细胞和肿瘤细胞,有效诱导肿瘤细胞毒性,但与传统BiTE不同的是,SiTE具有按需切换治疗的能力。传统BiTE引起的肿瘤非靶向毒性、细胞因子释放综合征和神经毒性难以控制。而SiTE可以通过注射小分子金刚烷胺(AMD)进行分解,从而在注射后立即停止可能出现的毒性作用。
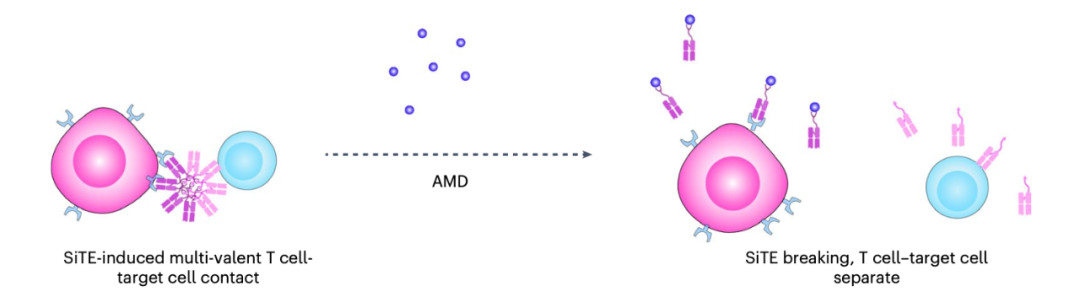
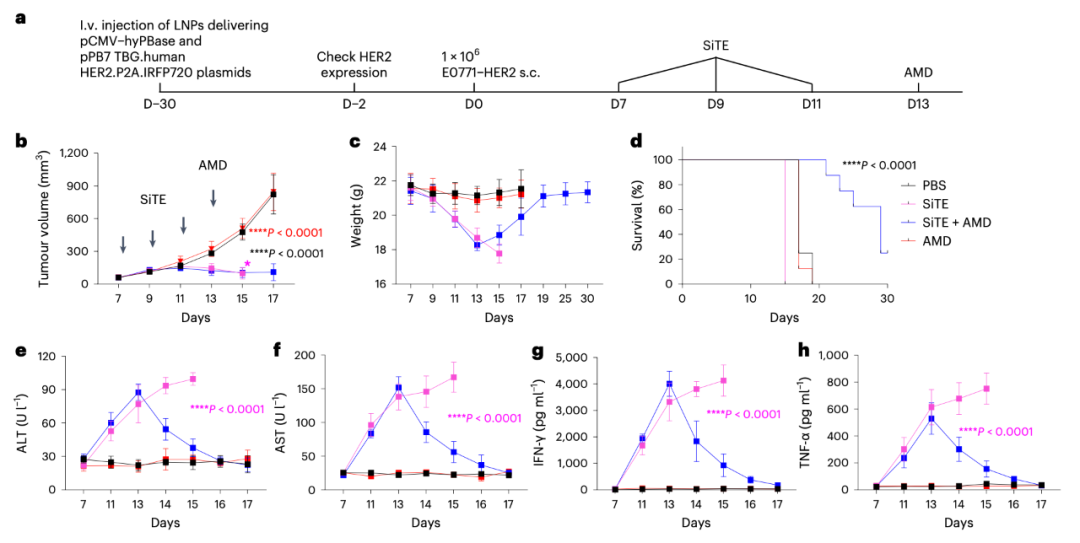
AMD降低SiTE在体内的肿瘤非靶向毒性
金刚烷胺(AMD)于1976年首次被美国FDA批准作为甲流的预防药物,随后被批准用于治疗帕金森病。因此,AMD是调控SiTE的理想候选者,因为其药代动力学特性和安全性已经在临床中得到了证实。研究团队评估了AMD响应性SiTE在体外和体内动物模型中的肿瘤细胞裂解能力,并证明了SiTE活性在体内的可控性。
此外,该研究开发了一种在健康肝脏组织中稳定表达人类HER2的小鼠模型,并研究了SiTE引起的非肿瘤毒性。该研究还比较了低剂量和高剂量下SiTE的治疗效果和抗肿瘤活性。并利用人源化免疫系统小鼠模型比较了SiTE和BiTE(blinatumomab)的抗肿瘤效果、肿瘤非靶向毒性、细胞因子释放综合征和神经毒性。
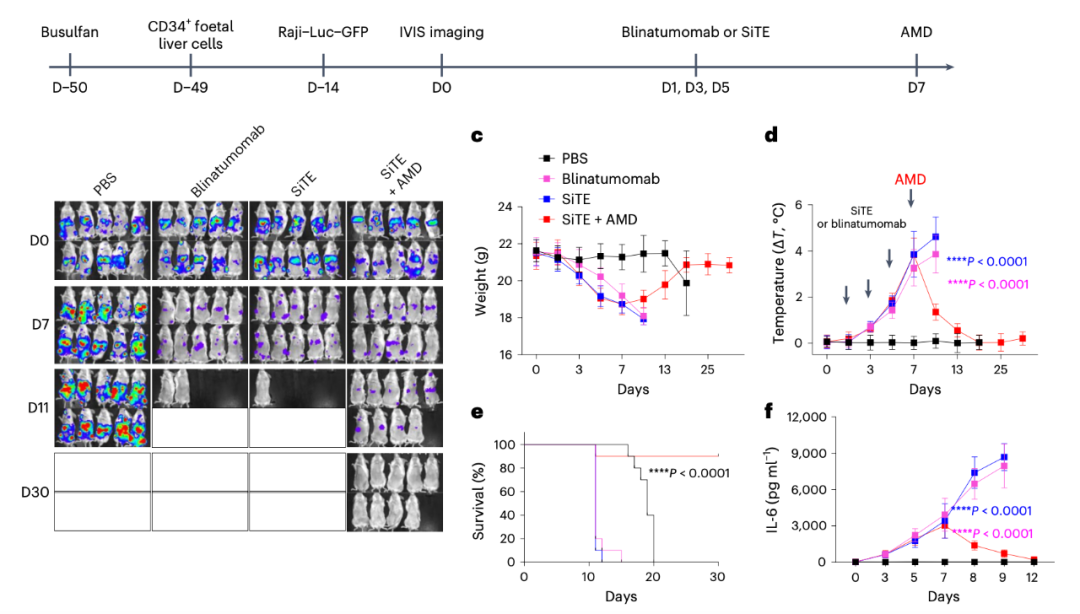
AMD降低SiTE在体内诱导细胞因子释放综合征(CRS)
总的来说,研究结果表明,SiTE可以诱导有效的抗肿瘤活性,且不会产生严重的肿瘤非靶向毒性、细胞因子释放综合征和神经毒性,这可能作为未来设计癌症免疫治疗的双特异性抗体的广泛适用策略,以避免非肿瘤毒性的产生。
值得一提的是,2023年9月11日,宫宁强博士作为第一作者在 Nature Materials 期刊发表了题为:In situ PEGylation of CAR T cells alleviates cytokine release syndrome and neurotoxicity 的研究论文【2】。
该研究构建了一种原位聚乙二醇化CAR-T细胞,能够在不影响CAR-T细胞肿瘤杀伤效果的情况下,降低细胞因子释放综合征(CRS)和神经毒性(neurotoxicity)。这项最新研究提示我们,可以通过单独使用材料调控细胞间的相互作用来实现疾病治疗,原位聚乙二醇化CAR-T细胞为更安全的CAR-T细胞治疗提供了巨大希望。
详情:https://mp.weixin.qq.com/s?__biz=MzU1MzMxMzcyMg==&mid=2247691553&idx=2&sn=1cb65bb9190be646b93afc44ebc20b4e&chksm=fbf919f4cc8e90e2d796e7fea698cd9492c8d98fa38cf1a9888d82250a0afc29136e4cdab27b&scene=21#wechat_redirect

宫宁强博士现为中国科学技术大学/合肥微尺度物质科学国家研究中心特任教授,宫宁强课题组的研究是一个涉及生物材料、药物递送以及基因、蛋白质和细胞工程的交叉领域。旨在深入理解并提供解决临床问题的基础性理论及策略。宫宁强课题组诚聘博士后,联系方式——gongn@ustc.edu.cn,详情见今天最后一条文章。
论文链接:
1. https://www.nature.com/articles/s41551-023-01147-6
2. https://www.nature.com/articles/s41563-023-01646-6
文章内容来源于“生物世界”公众号,本网站仅用于学术分享,如有侵权请联系管理员删除或修改。